Nova Lei da Investigação Clínica
Nova Lei da Investigação Clínica
Assembleia da República aprova a lei da investigação clínica
A Assembleia da República aprovou no passado dia 20 de Fevereiro a nova Lei de Investigação Clínica. O diploma foi publicado em 16 de Abril e deverá entrar em vigor em meados de Junho deste ano.
O diploma cria um normativo de referência para a investigação clínica, com o objetivo de enquadrar a investigação efetuada em diferentes áreas num quadro legal mais abrangente e harmonizado. Sob o conceito “umbrella” de estudos clínicos, o diploma abrange os ensaios clínicos com medicamentos, com dispositivos médicos, com produtos cosméticos e de higiene corporal e os estudos não intervencionais. Neste sentido, o diploma revogará a Lei n.º 46/2004 de ensaios clínicos e parcialmente o Decreto-Lei n.º 145/2009 no que respeita ao regime da investigação clínica de dispositivos médicos.
A Lei não traz alterações de fundo, mantendo-se todas as disposições da Diretiva n.º 2001/20/CE respeitantes à aplicação de boas práticas clínicas, bem como demais legislação europeia aplicável nesta área.
Destacamos as seguintes alterações:
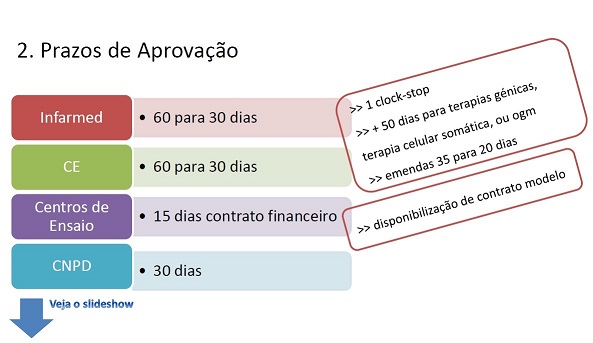
- Prazos de avaliação otimizados: INFARMED e Comissões de Ética (CEIC ou local): parecer de autorização de ensaio a emitir no prazo de 30 dias (em vez dos atuais 60 dias), com apenas um clock-stop; Centro de Estudo disponibilização de contrato financeiro modelo e prazo de avaliação de 15 dias; Comissão Nacional de Proteção de Dados: parecer no prazo de 30 dias
- Criação da Rede Nacional da Comissões de Ética para a Saúde com o objetivo de reforçar o papel das Comissões de Ética Locais
- Registo Nacional de Estudos Clínicos (RNEC): plataforma eletrónica para registo e divulgação de estudos clínicos (atual PNEC “em desenvolvimento”)
- Promoção da divulgação dos resultados dos estudos clínicos junto do público em geral e profissionais de saúde, através da RNEC, disponibilizando ou, na sua impossibilidade, indicando as publicações, apresentações e relatórios decorrentes dos estudos clínicos registados
O conjunto de alterações propostas pelo diploma são de uma maneira geral positivas. No entanto, per se, estas alterações não são suficientes e ficam aquém do necessário para tornar Portugal mais competitivo e invertermos a tendência de diminuição do nº de ensaios clínicos no nosso país.
Este diploma é um passo muito pequeno nesse sentido, talvez mesmo inconsequente, não estivéssemos em vésperas da aprovação do novo Regulamento Europeu sobre ensaios clínicos que obrigará a alterações profundas ao modelo atual, e que implica desde logo a revogação desta nova Lei.